Exemplos De Forças De Van Der Waals – As Forças de Van der Waals, um tema fascinante no mundo da química, desempenham um papel crucial em moldar as propriedades e interações de substâncias. Este artigo mergulhará no reino das Forças de Van der Waals, explorando seus tipos, exemplos e influência nas propriedades físicas.
Além disso, revelaremos suas aplicações práticas e sua importância na natureza, desvendando o papel vital que elas desempenham em nossa vida cotidiana.
As Forças de Van der Waals são forças fracas de atração que ocorrem entre moléculas neutras ou átomos. Essas forças são responsáveis por vários fenômenos físicos, como adesão, coesão e formação de cristais. Existem três tipos principais de Forças de Van der Waals: dipolo-dipolo, dipolo-induzido e forças de London.
Tipos de Forças de Van der Waals
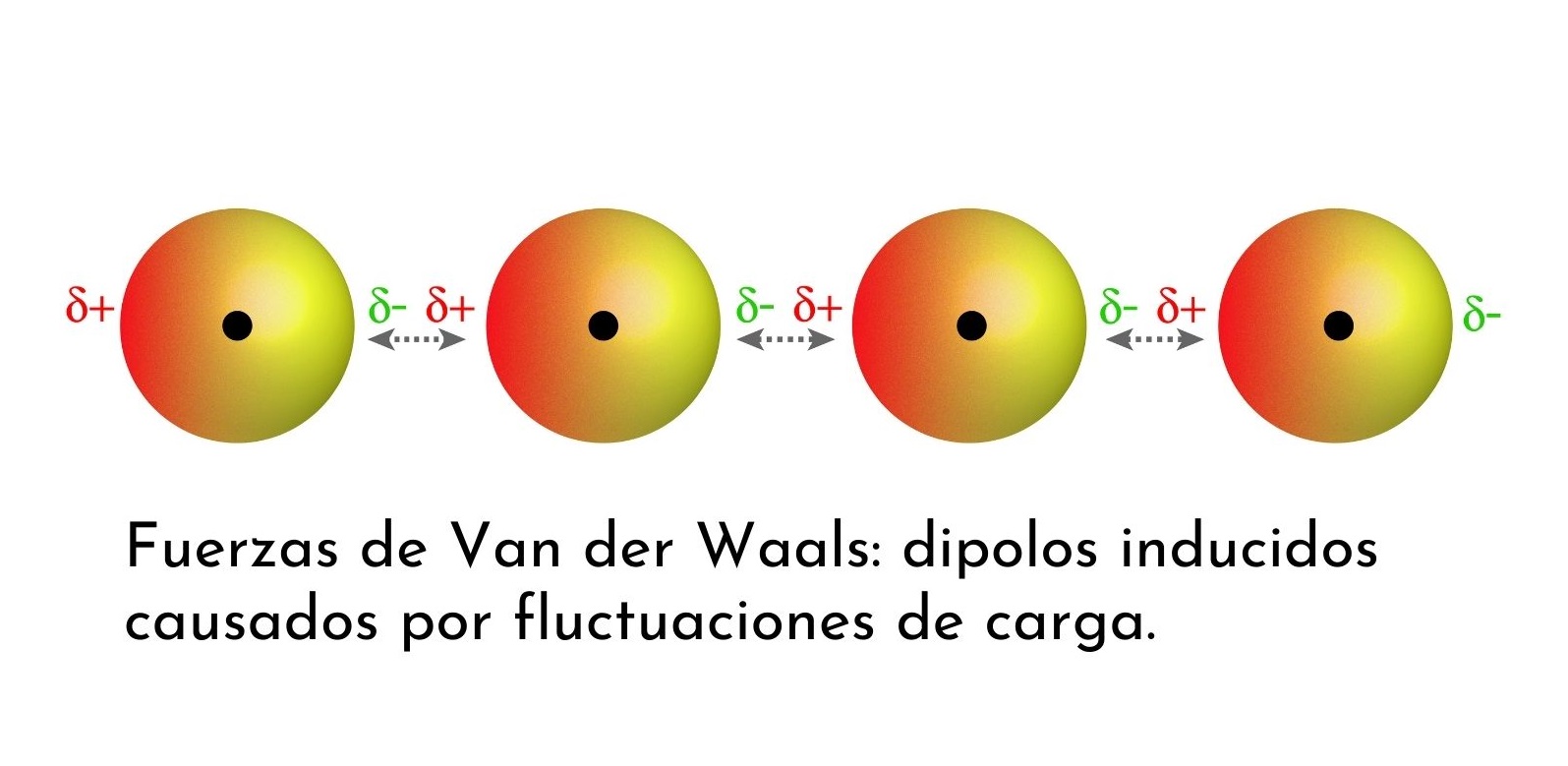
As forças de Van der Waals são interações fracas que ocorrem entre moléculas neutras. Elas são responsáveis por fenômenos como condensação, ebulição e adsorção. Existem três tipos principais de forças de Van der Waals:
Forças Dipolo-Dipolo
As forças dipolo-dipolo ocorrem entre moléculas polares, que possuem uma distribuição desigual de carga. As extremidades positivas de uma molécula são atraídas pelas extremidades negativas de outra molécula, resultando em uma força intermolecular.
Forças Dipolo-Induzido
As forças dipolo-induzido ocorrem entre uma molécula polar e uma molécula não polar. A molécula polar cria um campo elétrico que induz um dipolo na molécula não polar, resultando em uma força intermolecular.
Forças de London
As forças de London ocorrem entre todas as moléculas, independentemente da sua polaridade. Elas são causadas por flutuações instantâneas na distribuição de elétrons, criando dipolos temporários. Esses dipolos temporários podem induzir dipolos em moléculas vizinhas, resultando em uma força intermolecular.
Exemplos de Forças de Van der Waals em Substâncias
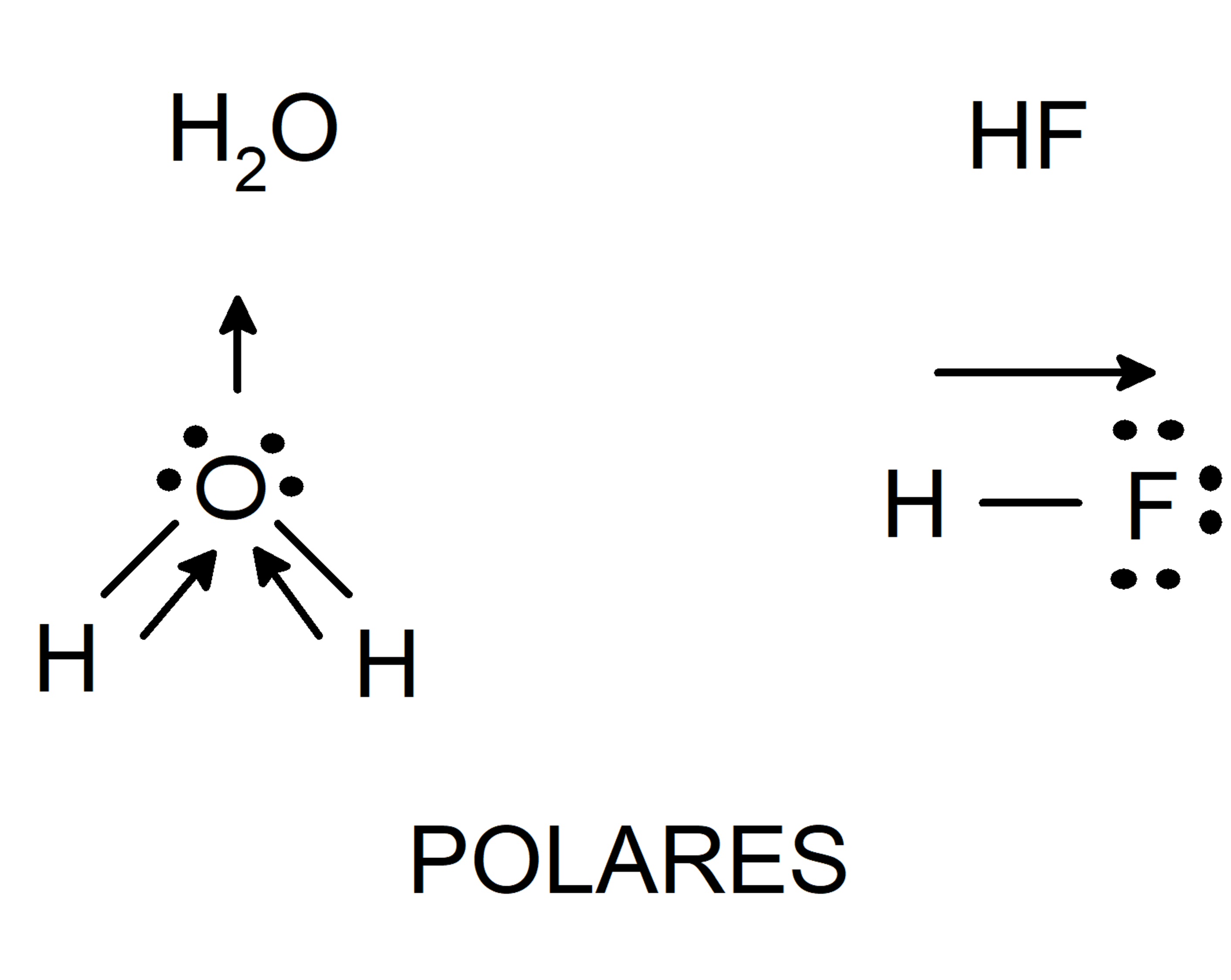
As forças de Van der Waals são forças intermoleculares fracas que atuam entre moléculas apolares ou entre regiões apolares de moléculas polares. Elas desempenham um papel importante em várias propriedades físicas, como pontos de ebulição, fusão e solubilidade.
Aqui estão alguns exemplos específicos de substâncias que exibem forças de Van der Waals significativas:
Substâncias Apolares, Exemplos De Forças De Van Der Waals
- Gases nobres:He, Ne, Ar, Kr, Xe e Rn. Essas substâncias consistem em átomos isolados que não formam ligações covalentes ou iônicas. As forças de Van der Waals são as únicas forças que mantêm esses átomos juntos.
- Alcanos:CH 4, C 2H 6, C 3H 8e assim por diante. Esses compostos consistem em cadeias de átomos de carbono ligados por ligações simples. As forças de Van der Waals entre os grupos CH 3são responsáveis por seus baixos pontos de ebulição e fusão.
- Éteres:R-O-R’. Esses compostos têm um átomo de oxigênio ligado a dois grupos alquila. As forças de Van der Waals entre os grupos alquila são responsáveis por seus pontos de ebulição e fusão relativamente baixos.
Substâncias Polares
As forças de Van der Waals também podem atuar entre regiões apolares de moléculas polares. Por exemplo:
- Água:H 2O. Embora a água seja uma molécula polar, ela também possui uma região apolar (os átomos de hidrogênio). As forças de Van der Waals entre as regiões apolares da água contribuem para sua alta tensão superficial e ponto de ebulição.
- Álcoois:R-OH. Esses compostos têm um grupo hidroxila polar (-OH) ligado a um grupo alquila apolar. As forças de Van der Waals entre os grupos alquila são responsáveis por seus pontos de ebulição e fusão relativamente baixos.
Tabela de Exemplos de Forças de Van der Waals
| Substância | Tipo de Força de Van der Waals | Exemplos de Interações ||—|—|—|| He | Dipolo instantâneo-dipolo instantâneo | Entre átomos de hélio || CH 4| Dipolo induzido-dipolo induzido | Entre grupos CH 3|| H 2O | Dipolo permanente-dipolo induzido | Entre a região apolar da água e a região polar de outra molécula || C 6H 14| Dipolo induzido-dipolo induzido | Entre cadeias de carbono |
Influência das Forças de Van der Waals nas Propriedades Físicas
As forças de Van der Waals desempenham um papel crucial na determinação das propriedades físicas das substâncias. Essas forças intermoleculares fracas influenciam aspectos como ponto de ebulição, ponto de fusão e viscosidade, afetando o comportamento físico geral das substâncias.
As forças de Van der Waals são forças fracas que atuam entre moléculas ou átomos neutros. Elas surgem devido a flutuações temporárias na distribuição de cargas, criando dipolos instantâneos que interagem com dipolos vizinhos. Essas interações podem ser classificadas em três tipos: forças de Keesom, forças de Debye e forças de London.
Influência nas Propriedades Físicas
As forças de Van der Waals afetam as propriedades físicas das substâncias das seguintes maneiras:
- Ponto de Ebulição:As forças de Van der Waals mantêm as moléculas juntas, tornando mais difícil que elas escapem para a fase gasosa. Substâncias com forças de Van der Waals mais fortes têm pontos de ebulição mais altos.
- Ponto de Fusão:As forças de Van der Waals também afetam o ponto de fusão, mantendo as moléculas na fase sólida. Substâncias com forças de Van der Waals mais fortes têm pontos de fusão mais altos.
- Viscosidade:As forças de Van der Waals entre as moléculas podem dificultar o fluxo, resultando em maior viscosidade. Substâncias com forças de Van der Waals mais fortes têm maior viscosidade.
Em resumo, as forças de Van der Waals influenciam as propriedades físicas das substâncias, determinando seus pontos de ebulição, pontos de fusão e viscosidade. Compreender essas forças é essencial para prever e controlar o comportamento físico das substâncias em diversas aplicações científicas e industriais.
Aplicações das Forças de Van der Waals
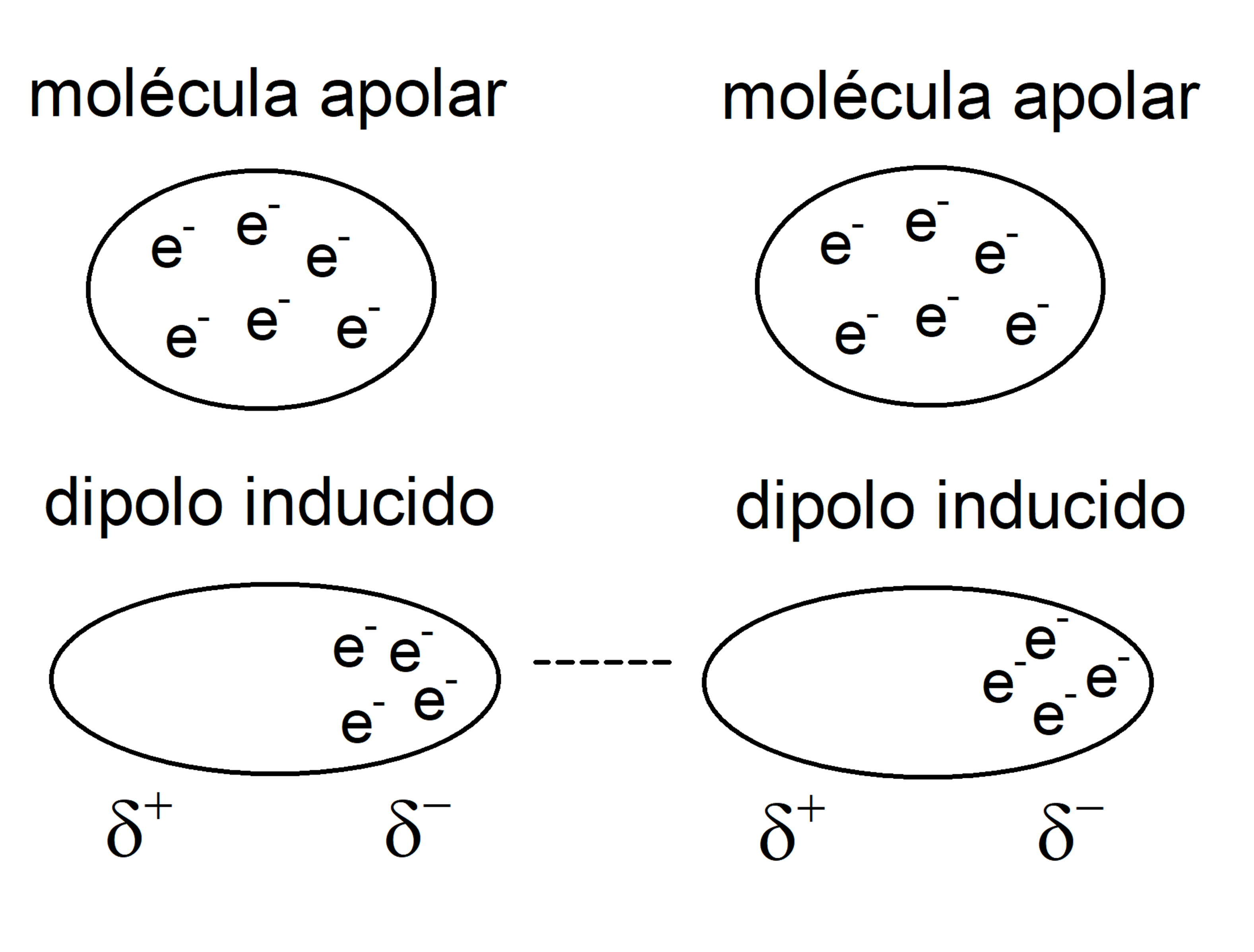
As forças de Van der Waals desempenham um papel fundamental em diversos campos, como ciência de materiais, medicina e biologia. Essas forças intermoleculares fracas influenciam as propriedades físicas das substâncias e são responsáveis por vários fenômenos e aplicações.
Ciência de Materiais
Nas ciências dos materiais, as forças de Van der Waals são cruciais para entender as propriedades mecânicas e térmicas dos materiais. Por exemplo, em compósitos de polímero reforçado com fibra, as forças de Van der Waals contribuem para a adesão entre as fibras e a matriz polimérica, melhorando a resistência e a rigidez do material.
Além disso, as forças de Van der Waals são essenciais na fabricação de nanomateriais. Os nanotubos de carbono e o grafeno, por exemplo, são materiais com propriedades excepcionais devido às fortes forças de Van der Waals entre as camadas atômicas.
Medicina
Na medicina, as forças de Van der Waals são fundamentais para o desenvolvimento de novos tratamentos e terapias. Por exemplo, na entrega direcionada de medicamentos, as forças de Van der Waals são usadas para encapsular medicamentos em nanopartículas que podem ser direcionadas a células ou tecidos específicos.
As forças de Van der Waals também desempenham um papel na interação entre proteínas e ligantes. O encaixe preciso entre as moléculas é mediado por forças de Van der Waals, que afetam a afinidade de ligação e a especificidade das interações proteína-ligante.
Biologia
Na biologia, as forças de Van der Waals são essenciais para a estrutura e função das biomoléculas. Por exemplo, as forças de Van der Waals entre as bases nitrogenadas estabilizam a estrutura de dupla hélice do DNA.
Além disso, as forças de Van der Waals são cruciais para as interações entre proteínas e outras biomoléculas. Essas forças influenciam a conformação das proteínas e a formação de complexos proteicos, que são essenciais para muitos processos biológicos.
Importância das Forças de Van der Waals na Natureza: Exemplos De Forças De Van Der Waals
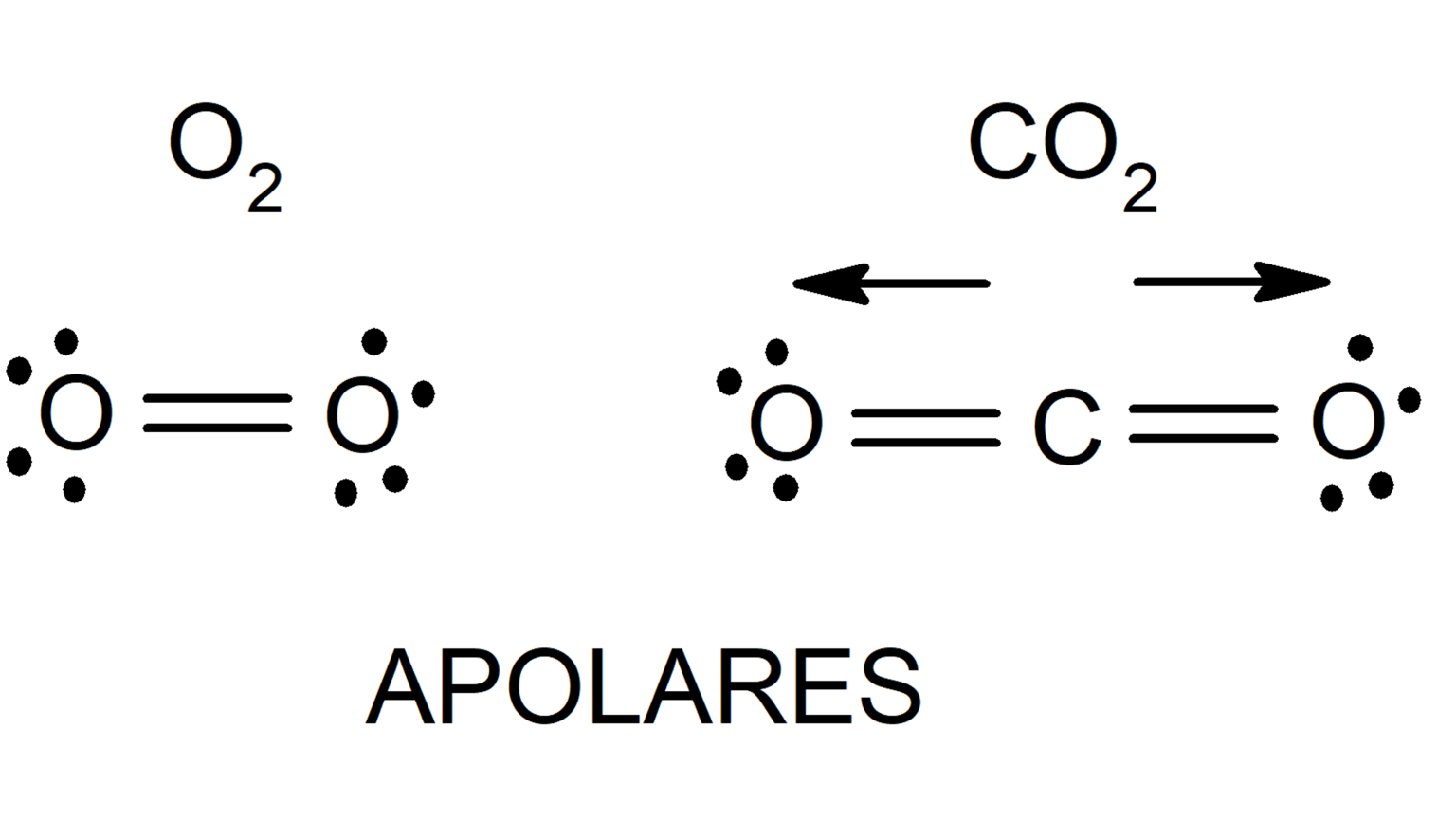
As forças de Van der Waals são essenciais para diversos fenômenos naturais, influenciando desde a formação de estruturas macroscópicas até interações moleculares.
As forças de Van der Waals contribuem para a adesão, a capacidade de duas superfícies diferentes se unirem. Por exemplo, as forças de Van der Waals entre as moléculas de água e a superfície de uma folha permitem que as gotas de água se agarrem à folha.
Essas forças também são responsáveis pela coesão, a capacidade das moléculas de uma substância se manterem unidas. Por exemplo, as forças de Van der Waals entre as moléculas de água permitem que a água forme gotas e permaneça líquida em temperatura ambiente.
Além disso, as forças de Van der Waals desempenham um papel crucial na formação de cristais. Elas orientam as moléculas para formar estruturas cristalinas ordenadas, como os cristais de sal e açúcar.
Em resumo, as Forças de Van der Waals são forças intermoleculares que influenciam significativamente as propriedades físicas das substâncias e desempenham um papel crucial em vários processos naturais e aplicações tecnológicas. Compreender essas forças nos permite entender melhor o comportamento das substâncias e desenvolver novos materiais e tecnologias inovadoras.

